
SCRUM-Japan Registry(スクラムジャパン レジストリ)

研究課題名
SCRUM-Japan疾患レジストリを活用した新薬承認審査時の治験対照群データ作成のための前向き多施設共同研究(SCRUM-Japan Registry)
概要
新しい治療薬を臨床の現場で使えるようにするためには、薬の有効性を確認するための「臨床試験」が必要です。臨床試験の結果をもとに製薬企業から、独立行政法人医薬品医療機器総合機構(PMDA:ピーエムディーエー)という国の委託機関に臨床試験の結果等が提出されます。
PMDAにて、製薬企業から提出された資料が審査され、薬の有効性が認められる(厚生労働大臣の承認が得られる)と、その治療薬が保険適用となり一般の臨床現場で使えるようになります。
通常、新しい治療薬の開発で実施される臨床試験は「比較試験」が実施されることが一般的です。
多くの比較試験では、無作為に「新しい薬剤を使用した治療を実施するグループ」(新薬グループ)と「新しい薬剤を使用しない治療を実施するグループ」(比較グループ)に分けて、治療経過等を比較します。その結果から、新しい薬剤を使用する治療を行ったグループが使用しない治療を行ったグループより良い効果が得られるかを評価します。
ただし、このように2つのグループに分ける比較試験では、参加いただく患者さんの数が少ないと実施することが出来ません。
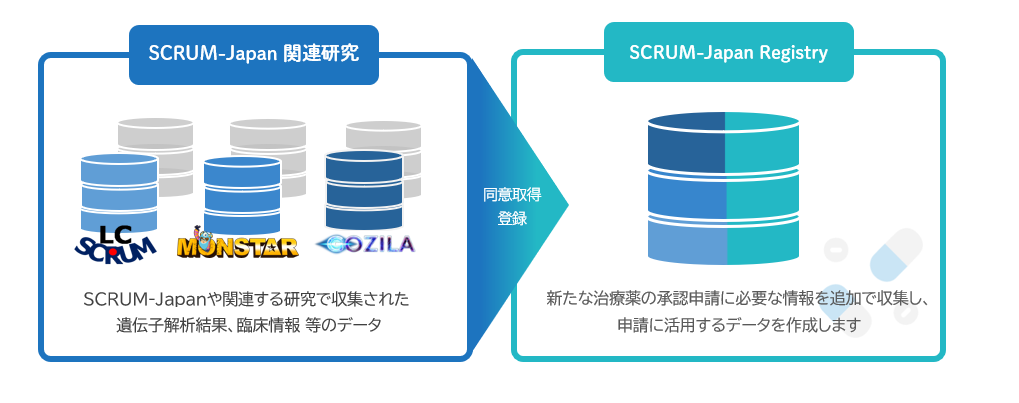
特に遺伝子異常に基づいた臨床試験では、特定の遺伝子異常を有する患者さんの割合が非常に低いため、十分な試験参加者を確保できず、比較試験を行うことが困難な場合が多くあります。その場合、新薬グループのみで実施する試験(単群試験)が実施されます。単群試験では、比較グループの情報が無いため、新しい薬剤の効果の判断根拠が比較試験に比べて薄くなってしまいます。
そこで、比較試験の実施が困難となる希少疾患に対して、カルテ情報が集積されているデータや他の試験で収集したデータ(疾患レジストリ)を比較グループとして活用する手法が世界的に注目されています。

成果
- 令和5年度「医薬品等審査迅速化事業費補助金(リアルワールドデータ活用促進事業)」SCRUM-Japan疾患レジストリを活用した新薬承認審査時の治験対照群データ作成のための前向き多施設共同研究(坂東英明) 2023年度リアルワールドデータ活用促進事業_活動報告(6MB)(PDF文書)
- 令和6年度「医薬品等審査迅速化事業費補助金(リアルワールドデータ活用促進事業)」SCRUM-Japan疾患レジストリを活用した新薬承認審査時の治験対照群データ作成のための前向き多施設共同研究(坂東英明/坂本泰理) 2024年度リアルワールドデータ活用促進事業_活動報告(1.8MB)(PDF文書)


